第一.背景と関連法規
新薬と後発医薬品との間によりよいバランスを取りたく、医薬業界のイノベーションを促進するため、2017年10月8日に、中国共産党中央弁公庁、国務院弁公庁が公布した「審査・承認制度の改革深化と医薬品・医療機器イノベーション推奨に関する意見」には、既に医薬品特許リンケージ制度の確立を模索することを提案した。
近年、知的財産権保護政策の全面的な強化の着実な推進に伴い、特許権者の合法的権益を確実に守ることや、後発医薬品上市後の特許権侵害リスクを低減すること、並びに薬物研究開発イノベーションを励むことが社会の注目を集めている。医薬品の上市審査・承認の段階で医薬品関連特許紛争解決のメカニズムを当事者に提供するため、2021年6月1日に施行された第四回目改正「特許法」の第76条には「医薬品特許紛争早期解決メカニズム」を正式に導入した。具体的な補助措置として、その後、下記の行政法規と司法解釈も相次いで制定された。
2021年7月4日に、国家医薬品監督管理局、中国国家知識産権局による「医薬品特許紛争早期解決メカニズムの実施弁法(試行)」(以下、「実施弁法」と略称する)が公布された。
2021年7月5日に、「実施弁法」に規定された司法ルートについて、最高人民法院による「登録申請された医薬品に関連する特許権紛争民事事件の審理における法律適用の若干問題に関する規定」(法釈〔2021〕13号)が公布された。
同日、「実施弁法」に規定された行政ルートについて、中国国家知識産権局による「医薬品特許紛争早期解決メカニズム行政裁決弁法」(以下、「裁決弁法」と略称する)及び「医薬品特許紛争早期解決メカニズム行政裁決に関する受理事項」も公布された。
これまで、これら一連の法律法規の公布に伴い、医薬品特許紛争早期解決メカニズムは中国で正式に設立され、中国の医薬品特許保護システムの重要な制度となる。
第二.医薬品特許紛争早期解決メカニズムの概要
医薬品特許紛争早期解決メカニズムとは、医薬品特許紛争解決手続きと医薬品上市承認手続きをつながる制度であり、「特許リンケージ制度」ともいう。以上の法律法規の関連規定からみると、中国の医薬品特許紛争早期解決メカニズムを以下の四つの部分に分かれることができる。①上市医薬品特許情報の登録と公開、②後発医薬品申請時の特許状況声明、③医薬品特許紛争の解決、④医薬品特許紛争解決手続きと国家医薬品監督管理局による承認手続きとのリンケージ。
医薬品上市許可保有者は上市医薬品関連特許情報を登録することで特許リンケージ制度を起動させる。登録済みの医薬品特許情報は公開され、後発医薬品の申請者が特許状況声明を行う根拠となる。国家医薬品監督管理局は後発医薬品の申請者が行った特許状況声明の種類及び医薬品特許紛争(第四類声明)の解決状況に基づいて後発医薬品の上市承認を行う。
1.上市医薬品特許情報の登録と公開
1.1 登録の目的
上市医薬品特許情報の登録と公開は医薬品特許リンケージ制度を実施する起点である。特許情報の登録と公開が行わないと、この制度が適用できない。医薬品上市許可保有者がその中国国内で上市されている医薬品の核心特許の関連情報を登録して社会に公開するために、国務院医薬品監督管理部門は「中国上市医薬品特許情報登録プラットフォーム」(https://zldj.cde.org.cn/home)を設立し、2021年7月4日より正式に利用可能とした。当該プラットフォームに登録された情報は後発医薬品の申請者が特許状況声明を出す時の根拠とする。
1.2 登録内容と登録(変更)期限
「実施弁法」第3~5条の規定によると、医薬品登録証を取得してから30日以内に、上市許可保有者は、医薬品の名称、関連特許番号、特許の種類、特許状況、特許権者、上市許可保有者、特許保護期間満了日、宛先、連絡者、連絡先等の内容を自ら登録しなければならない。
登録された医薬品特許情報が変更された場合、医薬品上市許可保有者は情報変更の効力が発生してから30日以内に中国上市医薬品特許情報登録プラットフォームに登録を変更しなければならない。
1.3 登録できる医薬品特許の種類
上市医薬品特許情報登録プラットフォームに登録できる医薬品特許は、下記のものが含まれる。
①化学医薬品について、医薬品有効成分の化合物特許、有効成分を含む医薬組成物特許、医薬用途特許の3種類がある。
②漢方薬について、漢方薬組成物特許、漢方薬抽出物特許、医薬用途特許の3種類がある。
③バイオ医薬品について、有効成分の配列構造特許と、医薬用途特許の2種類がある。
中間体、代謝物、結晶形、調製法、検査方法等の特許が登録できる特許に含まれない。
また、医薬用途特許権は承認された上市医薬品の説明書に記載している適応症または効能・効果と一致しなければならないことと、関連特許の保護範囲は承認された上市医薬品の対応する技術方案をカバーしなければならないことも規定されている。
2.後発医薬品申請時の特許状況声明
2.1 声明の種類
「実施弁法」第6条規定によると、後発医薬品の申請者は、医薬品上市許可申請を行う際に、先発医薬品の関連医薬品特許ごとに中国上市医薬品特許情報登録プラットフォームで公開されている特許情報と照合して声明を行わなければならない。
声明は以下の4種類に分けられる。
第一類声明:中国上市医薬品特許情報登録プラットフォームに先発医薬品に関連する特許情報は存在しない。
第二類声明:中国上市医薬品特許情報登録プラットフォームに収録された先発医薬品に関連する特許権はすでに終了・無効となり、または後発医薬品の申請者はすでに特許権者から関連特許の実施許諾を取得した。
第三類声明:先発医薬品に関連する特許が中国上市医薬品特許情報登録プラットフォームに収録されたが、後発医薬品の申請者は関連特許権の存続期間が満了する前に後発医薬品を上市しないことを約束した。
第四類声明:中国上市医薬品特許情報登録プラットフォームに収録された先発医薬品の関連特許権は無効すべきである(第4.1類声明)、またその後発医薬品は関連特許権の保護範囲に含まれない(第4.2類声明)。
後発医薬品は関連特許権の保護範囲に含まれない声明(第4.2類声明)を出す場合、根拠として、後発医薬品の技術方案と関連特許の関連請求項との対比表及び関連技術情報を提出しなければならない。
2.2 通知の義務:
後発医薬品の申請が受理されてから10営業日以内に、後発医薬品の申請者は声明とその根拠を上市許可保有者に通知しなければならない。
3.医薬品特許紛争の解決
3.1 解決ルート
医薬品上市許可保有者と後発医薬品の申請者は第四類声明をめぐって紛争が発生する場合、「特許法」第76条、「実施弁法」、法釈〔2021〕13号及び「裁決弁法」の規定によると、医薬品上市許可保有者側(関連特許の特許権者、被許諾者または登録された医薬品の上市許可保有者)と後発医薬品申請者側は、司法ルートと行政ルートとの2つのルートで当該紛争を解決することができる。
司法ルートと行政ルートの概要は以下の表にまとめる。
|
|
司法ルート |
行政ルート |
|
|
原告/請求人 |
医薬品上市許可保有者側が提出する |
関連特許の特許権者または利害関係者(被許諾者または登録された医薬品の上市許可保有者) |
関連特許の特許権者、被許諾者または登録された医薬品の上市許可保有者 |
|
医薬品上市申請者側が提出する |
医薬品上市申請者 |
||
|
訴訟提起/行政裁決の請求 期限 |
医薬品上市許可保有側 |
国家医薬品審査機関が医薬品上市許可申請を公表した日から45日(異議期間)以内 |
|
|
医薬品上市申請者側 |
特許権者または利害関係者は、国家医薬品審査機関が医薬品上市許可申請を公表した日から45日以内に、当該医薬品特許紛争について訴訟を提起しなかった時 |
||
|
被告/被請求人 |
医薬品上市許可保有側が提出する |
医薬品上市申請者 |
|
|
医薬品上市申請者側が提出する |
特許権者または利害関係者 |
特許権者 |
|
|
受理部門 |
北京知的財産法院 |
中国国家知識産権局医薬品特許紛争早期解決メカニズム行政裁決委員会 |
|
|
終局性 |
最終判断 |
最終判断ではない |
|
|
審理方式 |
開廷審理 |
書面または口頭審理 |
|
司法ルートと行政ルートの流れは大体下記のようになる。
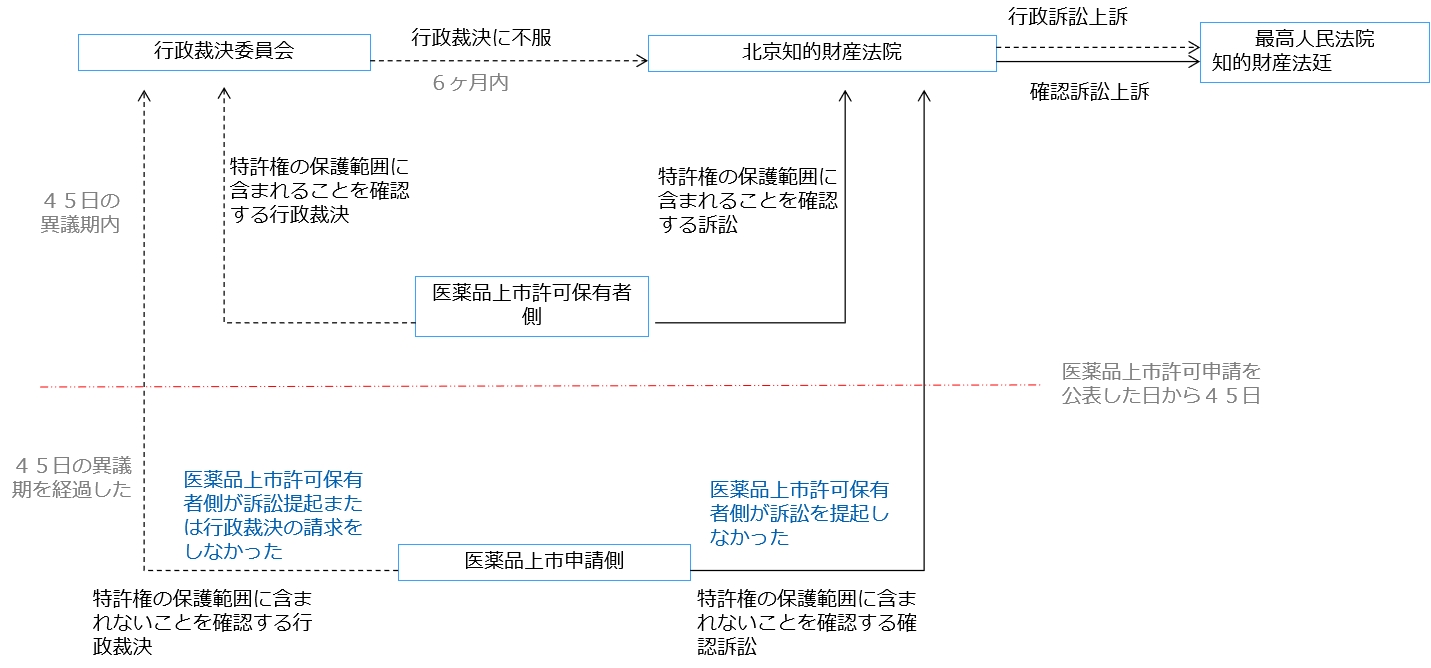
3.2 行政ルートの特徴
(1) 制約条件があること
「裁決弁法」第4条の規定によると、行政裁決の受理条件には、医薬品審査・承認過程における関連特許紛争が人民法院に受理されていないことが規定される。同一の特許紛争が人民法院に受理された場合、中国国家知識産権局は、当事者の行政裁決請求を受理しない。これは関連紛争が行政ルートまたは司法ルートのいずれか1つで解決されるようにし、手続きの無駄や衝突を避けるためである。
(2) 審理速度が速いこと
「特許行政法執行弁法」の規定によると、特許行政裁決の審理期限は3ヶ月で、案件が複雑である場合、1ヶ月を延長することができる。つまり、行政裁決は通常3~4ヶ月で裁決できる。これに対して、「民事訴訟法」の規定によると、民事一審事件の審理期限は6ヶ月(行政裁決より長い)で、二審は3ヶ月で、合わせてみると、9ヶ月の待機期間(下記4.1の内容を参照)内に最終判決が得られない可能性が高い。
また、医薬品特許紛争早期解決メカニズムの事件について、中国国家知識産権局は2021年7月5日に「医薬品特許紛争早期解決メカニズム行政裁決委員会」を設立し、専ら医薬品特許紛争の行政裁決を行う。これに対して、北京知的財産法院は、医薬品特許紛争以外にも多くの知的財産権事件を審理しなければならず、任務が重い。
これらの要素を総合的に考慮すると、行政ルートの審理速度はより速く、請求人は9ヶ月の待機期間内に審理結果を取得する可能性が高い。
(3) 手続きが簡便であること
訴訟を提起する際に、または行政裁決を請求する際に、いずれも当事者の主体資格証明と委任手続き書類を提出する必要がある。海外の特許権者にとって、中国国家知識産権局に行政裁決を請求する際に提出される主体資格証明、委任書に対して公証・認証を必要としない。これに対して、北京知的財産法院に訴訟を提起する際に、特許行政訴訟事件のような事前登録制度を実施していないため、提訴時に主体資格証明、委任書の公証・認証が必要とする。このような状況では、海外の特許権者にとって、行政ルート、または行政ルートと司法ルートとを組み合わせて医薬品特許紛争を解決した方がよいかもしれない。
3.3 訴訟ルートの特徴
(1) 行政手続きの制限がないこと
法釈〔2021〕13号第5条の規定によると、当事者は国務院特許行政部門がすでに特許法第76条の行政裁決請求を受理したことを理由に、特許法第76条に規定する訴訟を受理すべきではないかと主張するか、もしくは訴訟の中止を申立てる場合、人民法院はこれら主張を支持しない。
(2) 司法判决に特有のメリット
行政裁決に比べると、司法判决の権威性がより高く、紛争を終局的に解決することができる。さらに、司法ルートは当事者により多くの権利を与える。例えば、特許権者または利害関係者は行為保全を申立てる権利があり、人民法院に承認されば、直ちに特許権侵害行為を阻止し、侵害行為による損失のさらなる拡大を防ぐことができる。一方、医薬品上市申請者は法釈[2021]13号第12条の規定に基づき、悪意訴訟/行政裁決損害賠償請求訴訟を提起することができる。
司法ルートと行政ルートの上記特徴に基づいて、当事者は実際の状況に応じて、上記の要素を総合的に考慮した上で、司法ルート及び/又は行政ルートを適切に選択することができる。もちろん、和解を通じて双方の利益を最大化することも考えられる。
4.医薬品特許紛争解決手続きと国家医薬品監督管理局承認手続きとのリンケージ
4.1 待機期間
「実施弁法」第8条の規定によると、特許権者または利害関係者は後発医薬品の上市許可申請を公開した後45日(異議期間)以内に、申請された上市医薬品の関連技術方案が関連特許権の保護範囲に含まれるかどうかについて、人民法院に訴訟を提起するか、国務院特許行政部門に行政裁決を請求する場合、人民法院の立件日または国務院特許行政部門の受理日から、国務院医薬品監督管理部門は化学後発医薬品の上市許可申請に9ヶ月の待機期間を設定する。待機期間中、国家医薬品審査機関は技術審査評価を停止しない。
なお、第一類~第三類声明に対して待機期間を設定しない。第四類声明に対して、特許権者または利害関係者が「45日の異議期間」内に訴訟を提起する、または行政裁決を請求することは“待機期間”を引き起こすための必須要件である。その中、「45日の異議期間」の起算日は後発医薬品の上市許可申請の公開日であり、特許権者または利害関係者が後発医薬品申請通知を受けた日ではない。従って、異議期間内に効率的に対応できるように、特許権者は特許登録プラットフォーム上の情報を定期的に監視する必要がある。
また、同名称同処方の漢方薬とバイオシミラー医薬品の登録申請について、国務院医薬品監督管理部門は技術審査評価の結論に基づき、直接に医薬品の上市を承認するかどうかを決定する(即ち、行政承認の待機期間がない)。
米国の「30ヶ月の停止期間(30-month stay)」に比べ、後発医薬品承認の一時停止期間として、中国では「9ヶ月の待機期間」だけを設定する。これにより、行政機関と法院の審理速度に対してより高い要求を出していると同時に、双方当事者の訴訟コストを節約し、関連特許紛争の早期解決に役に立つ。
4.2 分類承認
「実施弁法」第9条、10条の規定によると、国務院医薬品監督管理部門は化学後発医薬品の申請者によって提出された特許状況声明の種類に応じて、医薬品審査・承認の分類処理を行う。
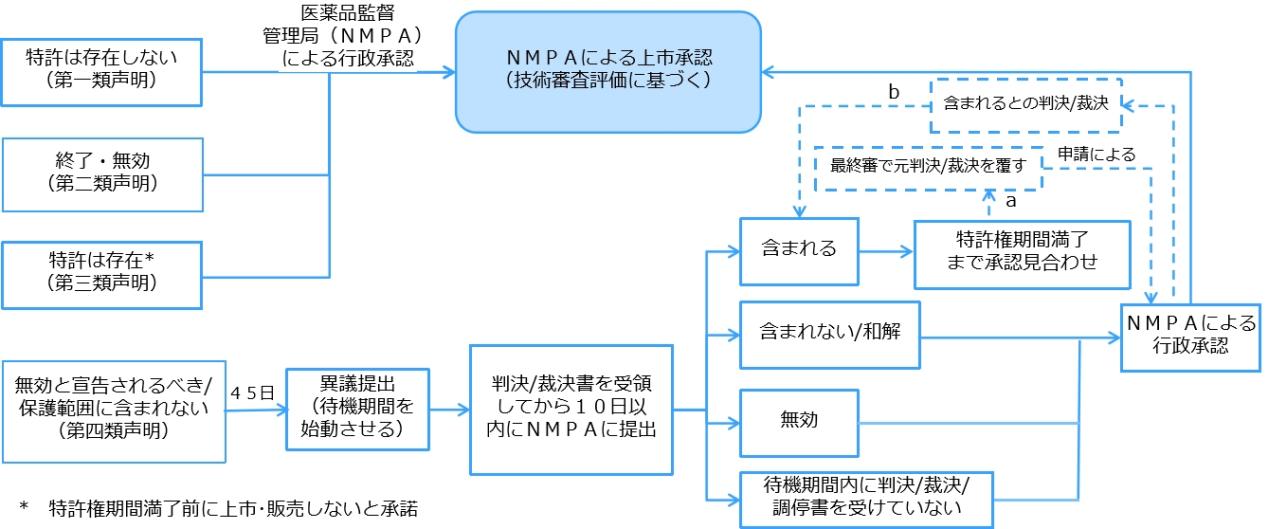
a:後発医薬品は特許権の保護範囲に含まれるため承認の見合わせを決定した後、法院が最終審で元の判決又は行政裁決を覆した場合、後発医薬品の申請者は医薬品監督管理局に上市の承認を申請することができる。それにより、行政承認手続きに入り、特許権期間満了まで待つ必要がない。
b:待機期間内に医薬品監督管理局が判決や裁定を受領しなかったが、行政承認段階で判决または裁決を受領し、後発医薬品は関連特許権の保護範囲に含まれることを確認した場合、手続きは「含まれる」場合の流れに移行する。
5.最初に挑戦成功した後発医薬品の市場独占期間
「実施弁法」第11条の規定によると、最初に特許チャレンジに成功し、最初に上市が承認された化学後発医薬品(「最初の後発医薬品」)には、「12ヶ月の市場独占期間」を与える。即ち、国務院医薬品監督管理部門は当該医薬品の承認日から12ヶ月以内に同種の後発医薬品の上市を承認しない(共同に特許チャレンジに成功した場合を除く)。市場独占期間は、チャレンジされた医薬品の元特許権期間を超えない。
米国の「30ヶ月間の市場独占期間」に比べると、中国は「12ヶ月の市場独占期間」を設定し、その長さは米国の約2倍である。米国では、「180日間の市場独占期間」はすでに「貴重なニンジン」とみなされているが、中国でのより長い独占期間は後発医薬品会社により大きなインセンティブを提供し、先を争って医薬品特許に挑戦し、後発医薬品を市場に投入することを促すことになる。
6.医薬品特許紛争早期解決メカニズムと後発医薬品上市後の訴訟との関係
特許権者または利害関係者は、医薬品特許紛争早期解決メカニズムを作動させないことを選択した場合、後発医薬品の上市が承認された後、通常の特許権侵害訴訟を提起することができる。ただし、その場合、訴訟結果はすでに法律に基づいて承認された医薬品上市許可決定の効力に影響を与えない。医薬品特許紛争早期解決メカニズムが適用されない特許については、特許権者または利害関係者は、後発医薬品の上市が承認された後に特許権侵害訴訟を提起することもできる。
第三.施行の状況
1.医薬品特許情報の登録状況
中国上市医薬品特許情報登録プラットフォームが2021年7月4日に正式に運行して以来、2022年5月まで、このプラットフォーム上の特許声明は300件余りとなった。
2.行政ルートによる紛争解決
2021年10月に、中国国家知識産権局は最初の医薬品特許紛争早期解決メカニズムに関連する行政裁決事件を受理した。現在まで、行政裁決請求は59件を受け取り、そのうち、39件は正式に受理された。
2022年4月25日に、中国国家知識産権局の公式Wechatには「中国国家知識産権局が結審した初の3件の医薬品特許紛争早期解決メカニズムに関する行政裁決事件」を掲載した。
この3つの事件は、それぞれ、第201210135209.X号、第201510599477.0号及び第201010151552.4号の特許権に関し、医薬品の種類がPurdue Pharma L.P.の「塩酸オキシコドン徐放性」である。特許権者は、宜昌人福薬業有限責任公司の後発医薬品の関連技術方案が上記特許権の保護範囲に含まれることを確認するようと裁決を請求した。審理を経て、中国国家知識産権局は、後発医薬品の関連技術方案が上記特許権の保護範囲に含まれないと認定した。
3.司法ルートによる紛争解決
2021年11月に、北京知的財産権法院は、初の「医薬品特許リンケージ」訴訟事件を受理した。原告の中外製薬株式会社は、被告の温州海鶴薬業有限公司が登録を申請した後発医薬品について行った第4.2類声明について訴訟を提起し、被告が登録を申請した後発医薬品が原告の特許権の保護範囲に含まれることの確認を請求した。
2022年4月15日に、北京知的財産権法院の公式Wechatには当該案件の判決結果を発表し、法院は審理を経て、「係争後発医薬品が係争特許権の保護範囲に含まれているとの原告の主張は成立せず、支持できないため、原告の訴訟請求を棄却する」との判決を下した。
第四.まとめと展望
現在実施されている一連の法規定から見ると、中国の医薬品特許紛争早期解決メカニズムは他国の経験を参考しながら、中国ならではの特徴もあり、期待できる有益な模索である。当該制度により、権利侵害後発医薬品の早期上市による新薬市場への侵害を回避でき、新薬研究開発企業が安心でイノベーションを継続し、医薬品業界のさらなる発展を促進できる。また、後発医薬品メーカーに特許権侵害リスクに関連する情報を早期に提供し、良好な医薬品運営環境を構築することができる。
米国の経験から見ると、米国のHatch-Waxman法案は、大量の医薬品特許訴訟事件を引き起こした。過去30年間、このような事件は米国の特許訴訟において大きな割合を占め、その中、中国製薬企業の姿もあった。中国の医薬品特許紛争早期解決メカニズムの実施に伴い、巨大な商業利益とインセンティブ政策に駆られ、後発医薬品企業と新薬企業は速やかに措置を講じ、積極的に出撃し、自らの利益の最大化を図ることでしょう。これにより、中国で医薬品関連特許訴訟の大爆発を引き起こす可能性がある。
紛争解決の面では、中国国家知識産権局、医薬品監督管理部門及び人民法院の良好な協力、メカニズム構築の改善、審理基準の統一、情報コミュニケーションの強化などを期待していいる。この制度の円滑な運行を確保することは、医薬品特許権者の合法的権益を守り、新薬の研究を奨励し、後発医薬品上市後の特許権利侵害リスクを低減することにつながる。



