序言
第4回目改正した「中国特許法」(以下、「改正特許法」と記す)は、2021年6月1日より正式に施行された。今回の特許法改正は、主に、権利者の合法的権益の保護強化、特許の実施と運用の促進、及び特許の権利化制度の改善とのいくつかの課題を中心に展開されており、その中で、権利者の合法的権益の保護を強化する目的で新たに導入された特許の存続期間補償制度は、特に注目を浴びている。
この制度はすでに業界で幅広い関心と活発な議論を引き起こしたことにも鑑み、本文は当該制度について、関連する法律規定も組み合わせて分析し解読してみる。
1.特許存続期間補償制度の概要
今回新設された特許存続期間補償制度は、審査手続きによる遅延を補償するための「特許付与期間補償」(PTA)と、薬品販売承認の審査による遅延を補償するための「薬品特許期間補償」(PTE)との2つの制度が含まれ、それぞれ改正特許法の第42条2項と3項に規定されている。具体的には、下記の通りである。
|
法規定 |
適用対象 |
適用理由 |
|
<42.2>PTA 特許の出願日から満4年、かつ実体審査請求日から満3年後に特許が付与された場合、国務院特許行政部門が特許権者の請求に応じて、特許の権利付与段階における不合理な遅延について特許権の存続期間の補償を与える。ただし、出願人に起因する不合理な遅延は除外する。 |
すべての特許 |
CNIPAでの審査手続きによる遅延 |
|
<42.3>PTE 新薬の販売承認審査にかかった時間を補償するために、中国で販売承認が得られた新薬関連特許について、国務院特許行政部門は特許権者の請求に応じて特許権の存続期間の補償を与える。補償期間は5年を超えず、新薬販売承認後の特許権の合計存続期間は14年を超えないものとする。 |
薬品特許のみ |
販売承認による遅延 |
すなわち、第42条2項の規定は、すべての特許(中国語で発明専利)を対象とされ、所定の時間要件を満たせば、国家知識産権局(CNIPA)による審査中の不合理な遅延により遅れた時間について、特許権者の請求に応じて期間補償を与えるものである。それに対して、第42条3項の規定は、薬品特許における新薬関連特許のみを対象とされ、国家薬品監督管理局(NMPA)が新薬についての販売承認審査で費やした時間を補償するものであり、同様に特許権者により自発的に請求しなければならないが、最終的に得られる補償期間は明確に制限される。
2.特許付与期間補償制度(PTA)
2.1 条文の解読
改正特許法第42条2項の規定と、これまで国家知識産権局により公布された関連規定とを合わせて考えれば、特許付与期間補償請求を提出するには、少なくとも以下4つの要件がある。
(1)対象要件
「2021年6月1日公告により権利が付与された特許」であること(国家知識産権局2021年5月24日に公布した『改正後の特許法の施行に関する審査業務処理暫定弁法』①(以下『暫定弁法』という)第5条)。
また、国家知識産権局2021年5月27日に公式サイトで発表した『改正後の特許法の施行に関する質問と解答』②(以下『質問と解答』という)では、「2021年5月31日(同日を含む)以前に権利化を公告した特許については、特許権存続期間の補償制度は遡及して適用されない」とも明確に規定されている。
(2)時間要件
「特許の出願日から満4年、かつ実体審査請求日から満3年後に特許権が付与された」こと。
ここで、「出願日から満4年」と「実体審査請求日から満3年」との2つの要件が同時に満たさなければならない。
(3)主体要件
「特許権者の請求に応じる」こと。
この点について、『特許法実施細則改正案(意見募集稿)』③(以下実施細則改正案という)の第85条の2条には、「特許権者は特許の権利付与公告日から3ヶ月以内に国務院特許行政部門に請求を提出しなければならない」とさらに詳しく規定されている。
(4)理由要件
「権利付与段階における不合理な遅延」であること。
「不合理な遅延」とは、「特許庁側による遅延のみに限られている」と解釈できる。実施細則改正案第85条の3において、改正特許法で明確に排除された「出願人による不合理な遅延」について、具体的に、「期限内に応答しない」、「遅延審査を申請した」、「引用による補充を行った」などの状況が挙げられている。
2.2 今後適用の見通し
特許法実施細則と関連する審査指南がまだ改正中なので、現在、特許付与期間補償制度の実施は、ただ、特許権者が上記要件を満たした特許について国家知識産権局に書面で期間補償請求を出される段階に留まっている。この請求はどのように審査されるか、必要な庁費用、具体的な補償期間に関連する費用計算などについては、まだ不明である。
但し、審査のスピードといえば、国家知識産権局は、国際的にすでにトップレベルに達している。去年まで、中国の特許審査期間は平均的に22ヶ月未満であったが、国家知識産権局が発表した『2020~2021年<知的財産保護の強化に関する意見>の徹底実施のための推進計画』④には、「特許の審査能力を引き続き高め、そのうち、高価値特許の審査期間を16ヶ月に短縮し、特許の審査期間を20ヶ月以内に短縮する」と明確に指摘した。
こうして、CNIPAで審査を受けたほとんどの特許出願は、実体審査請求日から3年以内に審査完了と想定でき、特許付与期間補償請求のすべての要件を満たすケースは、非常に限られると予想できる。
3. 薬品特許期間補償(PTE)
3.1 条文の解読
薬品特許期間補償制度は、今回の特許法改正で注目されたポイントの一つになる。
以下、改正特許法第42条3項の規定と、これまでに国家知識産権局により公布された関連規定も合わせて、薬品特許期間補償制度について説明する。
(1)薬品特許期間補償の提出時期
実施細則改正案第85条の7の規定によると、「特許権者が薬品特許期間補償を請求する場合、薬品販売承認申請が承認された日から3ヶ月以内に国務院特許行政部門に提出しなければならない。」
この点について、『暫定弁法』では、具体的に、「新薬販売承認申請が承認された日から3ヶ月以内に、書面で特許存続期間補償請求を提出し、その後、国家知識産権局が発行した費用納付通知に従って関連費用を納付する」と規定されている。
また、『質問と解答』では、「2021年5月31日(同日を含む)以前に販売承認を得た新薬関連特許については、薬品特許期間補償制度は遡及して適用されない」とも明確に規定されている。
これらの規定からわかるように、特許付与期間補償と同様に、薬品特許期間補償制度も、「遡及して適用されない」ことであり、2021年6月1日以降に販売承認が得られた新薬関連特許にしか、補償請求を提出できない。
(2)薬品特許期間補償の提出主体
改正特許法において、薬品特許期間補償請求を提出できるのが、「特許権者」に限られる、と明確に規定されている。
なお、中国のプラクティスにおいては、薬品特許権者と販売承認保持者が同一でない場合が非常に多い。この場合、薬品特許権者と販売承認保持者は協力して特許期間補償請求を行う必要がある。
この点について、例えば、国家知識産権局が2021年5月26日に発行した『特許法改正関連フォームの公布に関する通知』⑤に添付した「特許権期間及び薬品特許期間補償請求書」の添付資料として、「薬品販売承認保持者は特許権者が薬品特許期間補償を請求することに同意した証明書類」が挙げられている。
(3)薬品特許期間補償制度の適用対象
改正特許法第42条3項の規定によると、薬品特許期間補償制度の適用対象は、「中国で販売承認が得られた新薬関連特許」である。具体的に、以下の3つの要件を満たさなければならない。
第一に、「新薬」でなければならないこと。
この「新薬」について、まず明確にすべきなのは、ヒト用医薬品のみに限られ、 動物用医薬品や医療機器が含まれない。
また、実施細則改正案第85条の4の規定によると、「新薬」には、「化学薬品、生物製品、及び漢方新薬」の3種類が含まれる。
さらに、国家知識産権局が2020年11月10日に公開した『特許審査指南改正案(意見募集稿)』⑥第5部分第9章第3.4節においては、「国務院薬品監督管理部門が販売を承認した革新薬と本章の規定に合致している改良型新薬において、その中の薬物活性物質の製品特許、製造方法特許または医薬用途特許に対して、薬品特許期間補償を与えることができる……」と規定している。
これにより、「新薬」については、さらに、「革新薬とともに複数種類の改良型新薬も含む」と解釈され、審査指南改正案では、期間補償を与える可能である5種類の改良型新薬が明記されている。
なお、実施細則改正案も、審査指南改正案も、現時点で、まだ最終的に確定されたものではなく、正式な規定は上記意見募集稿の規定と一致しない可能性もある。但し、これらの規定から、少なくとも分かるのは、将来、国家薬品監督管理局により公布する「化学薬品登録分類及び申告資料要求」、「漢方薬登録分類及び申告資料要求」、「生物製品登録分類及び申告資料要求」における、化学薬品、生物製品、及び漢方新薬に対する規定に基づいて、薬品特許期間補償が可能となる薬品の範囲を確定できる。
第二に、「新薬関連特許」でなければならないこと。
まず、上記規定から、補償を請求できるのは、特許のみに限られ、実用新案及び意匠が含まれないことが明らかである。
さらに、実施細則改正案第85条の4には、ここの「関連特許」には、「製品特許、製造方法特許または医薬用途関連特許」が含まれると規定されている。そして、化学薬品と生物製品に関連する特許は、「国務院薬品監督管理部門が初回に販売を許可した新薬の有効成分に係る特許」に限定されており、漢方薬新薬に関連する特許は、「漢方薬革新薬に係る特許と機能特性を増やした漢方薬改良型新薬に係る特許」に限定されている。
第三に、「中国で販売承認を取得した」必要があること。
言い換えれば、中国で販売承認を取得していない新薬関連特許は、薬品特許期間補償制度に適用できない。
(4)薬品特許期間補償制度の適用制限
実施細則改正案第85条の7において、薬品特許期間補償制度の適用についていくつかの制限が設けられる。
「(1)一つの薬品について同時に複数の特許がある場合、特許権者はそのうちの一つだけの特許について薬品特許期間補償を請求できる。(2)一つの特許が同時に複数の薬品に係る場合、一つだけの薬品に関してこの特許について薬品特許期間補償を請求できる。(3)かかる特許がまだ薬品特許期間補償を受けたことがない。(4)薬品特許期間補償を請求する特許の残余保護期間は6ヶ月を下回らない。」
(5)薬品特許の補償期間
改正特許法第42条3項においては、「補償の期間は5年を超えず、新薬販売承認された後の特許権の合計存続期間は14年を超えない」と規定されている。当該規定は、下図に基づいてより直感的に把握できる。
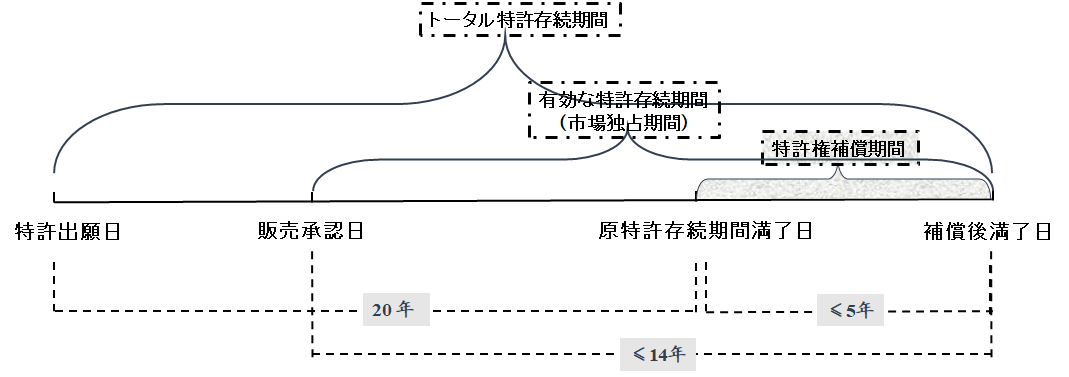
まず、実施細則改正案第85条の5では、「薬品特許期間補償の時間の計算方式は、 登録申請した新薬が中国で販売承認を取得した日から特許出願日を引き、更に5年を引くことである」と規定されている。即ち、次の計算式のようになる。
特許補償期間=販売承認日-特許出願日-5年
上記の式において、「販売承認日-特許出願日」は、該薬品がまだ市場に参入できない期間である。こうして、上記の規定における、5年を引く計算方法によれば、以下のように理解できるかもしれない。即ち、上記の式における、引いた「5年」は、特許権者が通常製品(薬品以外の製品)のように出願し、権利化され、さらに実施準備を行ったまでの期間だと想定する。そして、薬品関連特許の場合の特許補償期間といえば、販売承認審査のために通常製品の5年よりも余分に費やした時間を、特許権者に補給することである。
更に、上記式に基づいて、改正特許法第42条3項の規定も組み合わせて、以下のような結論をまとめることも試してみる。
すなわち、創薬型製薬企業が特許出願日から5年以内に薬品販売承認を取得できる場合、薬品特許期間補償を申請する必要はなくなる。
また、特許出願日から薬品販売承認を取得するまでにかかった時間は5~10年間であれば、薬品特許期間補償を申請することにより、最大14年間の販売後残余存続期間を獲得することができる。
もし、特許出願日から薬品販売承認を取得するまでにかかった時間は10年間超えたら、いずれも最高5年間の補償期間を獲得できるが、販売後残余存続期間は14年間未満となる。
(6)補償期間内の特許保護範囲
薬品特許期間補償を得られたとしても、補償期間内の特許保護範囲は、補償期間前の特許権とは完全一致とは言えないことは、注意すべきである。
実施細則改正案第85条の6によると、「薬品特許期間補償の期間内において、当該特許の保護範囲は、国務院薬品監督管理部門が販売を承認した新薬に限られ、且つこの新薬の承認された適応症に限られる」。
つまり、特許補償期間内おいて、特許の保護範囲は、補償期間前の特許権の保護範囲に準ずるものではなく、特定の適応症に対する特定の販売承認された薬品に関する請求項までに、限縮される。
これで、他国に比べて、中国では、薬品特許補償期間内の保護範囲が狭く限定されていることが分かる。例えば、1件の特許では、4種類の薬品ABCDについて限定される場合、そのうち薬品Aのみが国家薬品監督管理局により販売承認が得られ、当該薬品AのS適応症のみが承認された場合、特許補償期間内においては、S適応症を治療するための薬品Aのみがその特許権により保護されている。
3.2 今後適用の見通し
現在、薬品特許期間補償制度の実施も、ただ、特許権者が上記要件を満たした新薬関連特許について書面で国家知識産権局に請求を出される段階に留まっている。前述したように、実施細則改正案及び審査指南改正案では薬品特許期間補償制度についてより詳細な規定があるが、業界ではこの制度についてまだ多くの論争が存在しており、実施細則及び審査指南の正式な公布・施行に伴い、これらの論争を解決できるか否かは、引き続き考察・検討する必要がある。
一方、現時点で確定できるのは、薬品特許期間補償制度の確立は、特許薬品の市場独占期間を延長し、創薬型製薬企業の市場利益を大きく保障できるようになる。米国、ヨーロッパ、日本などの国における当該制度の実施状況からみると、薬品特許期間補償を提出した申請者は主に世界的な製薬大手企業に集中し、多くの薬品は4~5年間の延長保護を獲得しており、対象となった薬品には化学薬品が多数を占めるが、生物薬品の申請は多くなる傾向にある。
なお、中国の薬品特許期間補償制度は、米国、ヨーロッパ、日本などの国や地域の立法経験を参考して確立されたものであるが、一方的に国際統合したわけではなく、中国の製薬業界の事情と患者の医療負担などを十分考慮したうえでなされたものである。内容的には、中国独自の考え方が十分反映されている。上述したように、改正特許法、及びその他まだ正式に公布・施行されていない関連規定では、薬品特許期間補償の請求に対して適用制限、補償期間制限及び保護範囲など一連の制限が設定されおり、これらによって、薬品市場の正常な競争秩序を維持し、創薬型製薬企業がこれら新制度を通じて不当に市場独占を拡大することを防止する目的の達成が期待されている。
4. 特許存続期間補償請求の救済方式
特許権者により提出した特許権存続期間補償請求(特許付与期間補償請求と薬品特許期間補償請求との両方を含む)について、国務院特許行政部門は、却下や、期限補償を与えるとの決定を下す。そして、これら決定に対する救済方式として、実施細則改正案第85条の8には以下のように規定されている。
即ち、「国務院特許行政部門が期限補償を与えると公告した日から、如何なる機関又は個人は期限補償を与える旨の決定が補償条件に合致しないと考える場合、国務院特許行政部門にこの期限補償決定の無効を宣告するよう請求することができる。請求人又は特許権者は期限補償有効維持の決定や期限補償無効宣告の決定に不服がある場合、通知を受領した日から3ヶ月以内に人民法院に提訴することができる。人民法院はこの無効宣告請求手続きの相手側当事者に第三者として訴訟に参加するよう通知しなければならない。」
5. 結語
新たに導入された特許存続期間補償制度は、疑いもなく特許権者の合法的権益の保護を大幅に強化できるようになる。それと同時に、正常な市場競争秩序を維持し、新制度の濫用による不当な市場拡大や独占を防止する目的で、これからのより詳しい関連規定には厳格な制限要件を設定することになる。
したがって、より多くのルートにて、より全面的な特許保護を図るためには、特許存続期間補償制度の導入による利益を享受すると同時に、特許権者は、積極的に特許レイアウトを行っておき、保護範囲が明確で広いコア特許出願を早期に提出するもとに、コア特許の継続的な改善を通じて、特許サイクルの延長を図り、競合他社の模倣と市場への参入を制限することが考えれる。
<参考資料>
① 国家知識産権局が2021年5月24日に発表した「改正後の特許法の施行に関する審査業務処理暫定弁法」。
(https://www. cnipa.gov.cn/art/2021/5/25/art_2073_159679.html)
② 国家知識産権局が2021年5月27日に公式サイトで発表した「改正後の特許法の施行に関する質問と解答」。
(https://www. cnipa.gov.cn/art/2021/5/27/art_2073_159683.html)
③ 国家知識産権局が2020年11月27日に公開した「特許法実施細則改正案(意見募集稿)」
(https://www.cnipa.gov. cn/art/2020/11/27/art_75_155294.html)
④ 国家知識産権局が2020年4月20日に公開した「2020~2021年<知的財産権保護の強化に関する意見>推進計画」
(https://www.cnipa.gov.cn/art/2020/4/20/art_53_118147.html)
⑤ 国家知識産権局が2021年5月26日に公式サイトで発表した「特許法改正関連フォームの公布に関する通知」。
(https://www. cnipa.gov.cn/art/2021/5/26/art_564_159648.html)
⑥ 国家知識産権局が2021年8月3日に公開した「特許審査指南改正案(意見募集稿)」
(https://www. cnipa.gov.cn/art/2021/8/3/art_75_166474.html)



